Sie befinden sich hier
Inhalt
Die Forschungsgruppe Translationale Neurobiologie unter der Leitung von Prof. Dr. med. Lucas Schirmer hat sich im Oktober 2018 gebildet. Für weitere Details verweisen wir auf unsere Sektionswebseite und unsere separate Laborwebseite: www.schirmerlab.com.
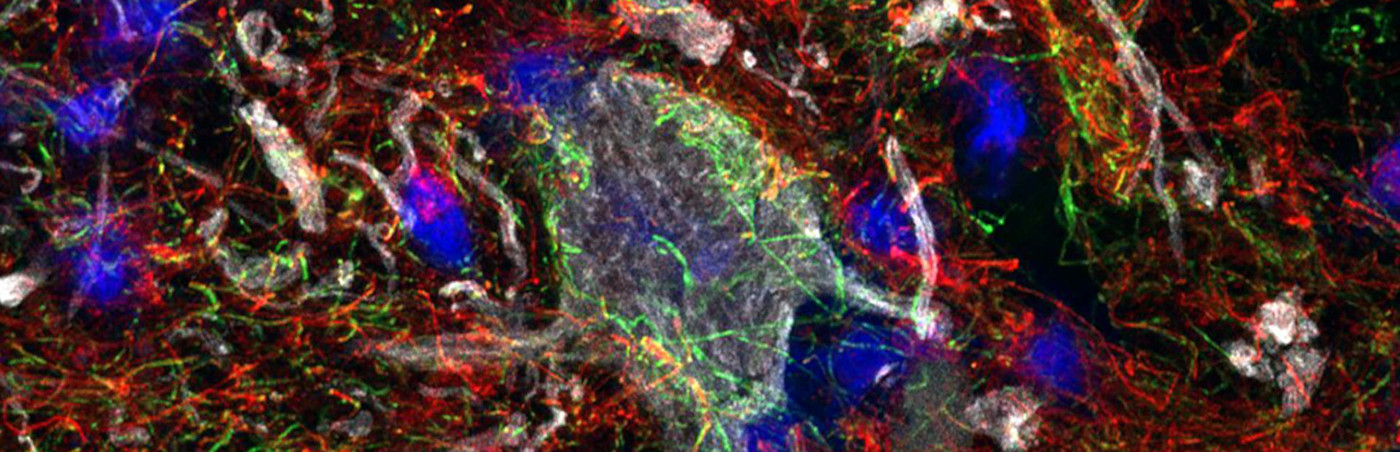
Die Arbeitsgruppe beschäftigt sich mit molekularen und zelltypspezifischen Mechanismen der Krankheitsprogression bei chronischen neuroinflammatorischen Prozessen wie bei der Multiplen Sklerose (MS). Im Fokus stehen einerseits translationale experimentelle Modellsysteme und andererseits Hochdurchsatzverfahren für eine hochauflösende und zelltypspezifische Charakterisierung von molekularen Veränderungen im entzündeten Gewebe.
Über die letzten Jahre konnten wir wichtige Mechanismen von neuronalen und axonalen Schädigungsmustern als pathologische Korrelate der permanenten neurologischen Behinderung bei der MS identifizieren. Bereits früh in der Läsionsentstehung zeigt sich eine relevante neuronale Stressreaktion, die zu Degeneration und zum Untergang von Nervenzellen bei MS-Patienten führt (Schirmer et al., Annals of Neurology, 2009). Darüber hinaus konnten wir eine progrediente axonale Degeneration entlang langer kortikospinaler Bahnen im Laufe der Läsionsentwicklung zeigen, die einen wichtigen Beitrag zur permanenten Behinderung bei der MS darstellt (Schirmer et al., Brain Pathology 2011). Mithilfe eines experimentellen Modellsystems konnten wir zudem zeigen, dass eine Dysregulation und ein Verlust der Funktion des glialen Kaliumkanals Kir4.1 zu einer progredienten axonalen Schädigung und letztlich Degeneration führt (Schirmer et al., eLife, 2018). Passend dazu fanden wir eine zelltypspezifische Dysregulation in der Expression des Kanals in Astrozyten und Oligodendrozyten am Randbereich von chronisch aktiven MS-Läsionen (Schirmer et al., Annals of Neurology, 2014)
Um molekulare und zelltypspezifische Mechanismen bei der chronischen Neuroinflammation zu untersuchen, arbeiten wir mit hochauflösenden Genexpressionsverfahren, um das Transkriptom einzelner Zellen im entzündeten Gewebe zu untersuchen (single-cell RNA-sequencing). In Kooperation mit lokalen, nationalen und internationalen Partnern wenden wir diese Hochdurchsatzverfahren im Gewebe unterschiedlicher neuroinflammatorischer Krankheitsentitäten an mit dem Ziel eines besseren Krankheitsverständnisses und einer Identifizierung neuer potentiell therapeutischer Zielstrukturen im Gewebe. So konnten wir kürzlich in kortikalen MS-Läsionen mit diesen Verfahren eine differenzielle Schädigung und Degeneration von exzitatorischen Projektionsneuronen in den oberen kortikalen Schichten demonstrieren – pathologische Veränderungen, die regelhaft mit einer Entzündung im Bereich der Hirnhäute assoziiert sind.
Prinzipiell beschäftigen wir uns mit zelltypspezifischer Heterogenität und Veränderungen von Immunzellsubtypen bei akuten und chronischen neuroinflammatorischen Erkrankungen des zentralen (MS, ADEM, NMO, MOGAD) und peripheren Nervensystems (GBS, CIDP) einschließlich entzündlicher Muskelerkrankungen (IBM, PM). Hierzu arbeiten wir mit frischen und kryokonservierten Proben von Patienten und wenden zelltypspezifische Hochdurchsatzverfahren wie fluoreszenzbasierte Durchflusszytometrie und Einzelzellsequenzierungsverfahren an. In der Vergangenheit konnten wir beispielsweise zeigen, dass es im Nervenwasser von MS-Patienten zu einer differenziellen Anreicherung von sogenannten γδ-T-Zellen kommt, die mit der Krankheitsaktivität korreliert (Schirmer et al., JAMA Neurol, 2013).
Koordination
Prof. Dr. med. Lucas Schirmer
Leitung der Sektion Neuroimmunologie und Tagesklinik
Leitung der AG Translationale Neurobiologie
Professur für Translationale Neurobiologie
Geschäftsführender Oberarzt und Lehrkoordinator
Neurologische Klinik
Lucas.Schirmer@medma.uni-heidelberg.de
Katrin Kauf
Administration der Sektion Neuroimmunologie
Study Nurse – Klinische Studien Neuroimmunologie
Katrin.Kauf@medma.uni-heidelberg.de